證券時報記者 李映泉
今年以來,中國創新藥產業取得矚目成績,10億美元以上的大額對外授權(BD)交易頻現,僅上半年的對外授權交易金額就已接近去年全年水平。
成績令人欣喜,隱憂也逐漸浮現。中國創新藥企業一次次將新藥專利授權給國際醫藥巨頭,其價值是否真正得到體現?交易的定價權又在誰的手中?中國創新藥是否存在低估?
“賤賣”之殤
今年6月,“抗癌神藥”BNT327的交易轟動醫藥界。百時美施貴寶與BioNTech達成合作,獲得聯合開發和銷售BNT327的權利。BioNTech將獲得15億美元預付款,2028年前再獲得20億美元;后續還將獲得高達76億美元的里程碑款項,交易總金額達111億美元(約合800億元人民幣)。
這款“身價百億”的新藥是何來頭?事實上,它源自中國創新藥企業普米斯。2023年11月,BioNTech從普米斯手中取得BNT327的海外授權,首付款0.55億美元。2024年11月,BioNTech以8億美元現金和1.5億美元里程碑款全資收購了普米斯,將其改為BNT中國研發中心。總耗資約10億美元,BioNTech就獲得了BNT327在全球(包括中國)的權益。
如今,BioNTech僅憑15億美元的預付款就收回了BNT327的全部投資成本,未來還將獲得96億美元后續款項,整體回報超過10倍,相當于“一折”價格從中國企業購入創新藥授權。付出大量心血的中國企業和研發人員無緣這巨額的回報。
與普米斯的遭遇相似,2023年8月,恒瑞醫藥與Aiolos Bio達成協議,將SHR-1905(AIO-001)大中華區外的全球權益授予Aiolos Bio,獲得2500萬美元首付款和近期里程碑付款,以及潛在的10.25億美元研發及里程碑款。短短5個月后,GSK就以14億美元的總交易額整體收購Aiolos Bio,收購時,后者唯一核心管線便是來自恒瑞的AIO-001。
近年來,類似的情況屢見不鮮。國內一家生物醫藥創投機構負責人表示,其投資的近50家國內創新藥企無一例外都在尋找買家。因為市場估值低、潛力大,國產創新藥企的新藥管線現在已成為跨國巨頭眼里的“潛力股”。“東西是我們自己研發的,卻在上市前就被‘賤賣’。‘一賣一買’之間,往往存在不菲的差價,就像在‘賣青苗’。”
創新藥研發歷來都具有高投入、高風險、長周期的特點。國際上常有“三個10”的說法,即耗時10年、耗資10億美元(含研發失敗成本)、成功率不足10%。據BIO統計數據,創新藥從臨床一期到獲得FDA(美國食品藥品監督管理局)批準上市的成功率平均為7.9%,一款研發成功的創新藥背后包含了大量研發失敗的沉沒成本。
然而,即便是在“九死一生”中闖關成功的國產創新藥研發成果,其定價權卻并不掌握在中國企業手中。
“近兩年,國內有很多藥企賣掉了自己的管線,表面看很熱鬧,似乎是我國醫藥研發能力得到世界認可的有力證明。但這其中有很多的不得已,企業明知道當前并不是出售的好時機,但為了解決資金困境,只能選擇賣掉。這對于整個產業來說雖不是毀滅性的打擊,但將一些有潛力的管線賣給了國外,國內企業就失去了進一步挖掘和發展的主動權。”上海市衛生和健康發展研究中心主任金春林表示。
醫藥魔方董事長周立運也表示,盡管對外授權在國際成熟生物醫藥產業鏈中是一種常態化的商業模式,但在中國當前的環境下,此舉更多是一種被動式的無奈之舉。由于資金不足,許多企業不得不將最優質的管線對外許可,導致中國的創新藥資產被低估。這種困境如果長期延續,國內創新藥產業可能面臨“斷檔”風險,新一代藥物研發將后繼乏力。
定價之痛
在大量創新藥企“賣青苗”的背后,一個無法回避的原因在于,僅靠中國市場很難收回成本。業內普遍反饋:“如果創新得不到回報,就很難有人堅持做創新。”在這一方面,一個顯性的標志就是國產創新藥的中外定價價差過大。
以君實生物240mg特瑞普利單抗為例,該產品在美售價為8892美元/瓶,按匯率換算后是國內醫保價格的33倍;億帆醫藥的F-627在美國定價是國內定價的14倍;和黃醫藥呋喹替尼中美單位價差達24倍。普遍來看,國產創新藥的中美價差大多在十幾倍至三十幾倍之間。
相比之下,進口創新藥的中美價差卻小很多。例如,默沙東的K藥和BMS的O藥在美國的定價均為中國定價的2倍左右,ADC“神藥”Enhertu在美國的年治療費用約為中國的2.3倍。
中國醫藥創新促進會執行會長宋瑞霖去年表示,我國創新藥長期處于全球版圖上的價格洼地,談判價格相較于最低國際參考價的中位價再低約39%。這導致作為全球第二大藥品市場的中國,創新藥在全球醫藥市場占比僅為3%,與創新大國的定位顯然不匹配。
“不能把創新藥變成白菜幫子價,那誰也不做創新了。商業和市場經濟要有規矩,便宜沒好貨,好貨不便宜。”哈爾濱血液病腫瘤研究所馬軍教授在一場采訪中表示。
金春林也表示,一些國內自主研發的藥物在國內外的市場出現了10—20倍的差價,部分藥物在國內的定價過低,這些藥企完全靠中國市場回收成本非常困難,只能走向海外,但出海也并不容易。
周立運指出,由于中國人均醫療衛生開支遠低于美國等發達國家,創新藥在國內的定價普遍較低,這種定價體系不僅影響了國內市場的利潤空間,還影響了中國創新藥企在國際舞臺上的議價能力。
百濟神州全球總裁吳曉濱也表示,相比被批量生產出來的仿制藥,創新藥前期需要持續投入大量的研發成本,如果只考慮生產成本,創新藥企業將永遠得不到成長。目前單獨靠國家醫保基金難以支持創新藥研發,當下需要進一步拓展商保等多元化的支付手段。
入院之難
如果說,定價低主要影響的是創新藥企業的回報,那么入院難的問題,則在更大程度上攸關企業生死。
在國內,新藥進醫院需要遵循《醫療機構藥事管理規定》。該規定明確,由醫院藥事委員會建立藥品遴選制度,審核臨床科室申請的新購入藥品、調整藥品品種或者供應企業等事宜;藥品的采購供應由藥學部門統一負責,涉及醫院里從院長到藥房等諸多環節的把關。
在創新藥企業眼中,新藥入院被喻為過“七大關”,分別為臨床科室主任、藥劑科主任、院長或負責藥事的副院長、藥事委員會、臨床醫生、藥房或者信息科、財務科。新藥進院難的現狀,讓創新藥企業不得不面臨漫長的市場準入周期。
據周立運透露,美國一款新藥上市后半年的銷售額就可以達10億美元,而在中國市場,新藥從上市到銷售額滿10億元人民幣,往往需要長達10年的時間。這種時間成本直接影響了創新藥企業的商業回報。
今年全國兩會上,全國政協委員、中國醫學科學院阜外醫院麻醉科主任醫師敖虎山表示,當前創新藥和高端醫療設備進入醫院面臨多重機制障礙,導致醫藥科技創新企業研發投入乏力。全國政協委員、揚州大學副校長龔衛娟也表示,國內創新藥存在醫院準入門檻高、覆蓋率低等瓶頸,致使創新藥收益增長緩慢,制約了醫藥企業創新積極性。目前,創新藥物在醫藥市場的整體占比還偏低,我國傳統的“重住院、輕門診”醫保模式制約了創新藥的臨床使用。
破解之道
無論是定價低還是入院難,當前創新藥企業面臨的核心痛點,就是缺乏一個強大的內需市場建立“內循環”。而在面向全球市場時,鑒于國際巨頭在全球市場的渠道和品牌優勢,中國企業在談判中天然占據弱勢地位,難以掌控定價權。
“單靠海外市場,想把產業建起來是不可能的。”迪哲醫藥創始人、董事長張小林表示,從戰略角度出發,沒有哪個國家有很強的醫藥行業,卻沒有強大的本土市場。
好在,這一痛點已經在最新的政策中得到關切。
6月30日,國家衛健委、國家醫保局聯合印發《支持創新藥高質量發展的若干措施》,在5個方面提出16條具體措施,業內稱之為“16條”。其中,“商業健康保險創新藥目錄”的確立是最大亮點之一。
“商保創新藥目錄是健全多層次用藥保障體系的第一步。”國家醫保局醫藥服務管理司司長黃心宇表示,該目錄將明確基本醫保保障邊界,為超出基本醫保承受力的高價值創新藥提供新支付渠道。醫保部門還將為目錄內藥品提供“刪除外支持”,即不納入基本醫保自費率考核、不列入集采可替代藥品監測范圍、相關病例可不納入按病種付費。
針對創新藥入院難問題,國家醫保局醫保中心副主任王國棟表示,首要任務是推動創新藥積極進入醫療機構。“16條”明確要求醫療機構不得以“藥占比”或“品規數量限制”為由影響創新藥配備,特別是醫保和商保創新藥目錄內的品種可突破“一品兩規”限制。鼓勵醫療機構及時召開藥事會,根據臨床和患者需求完善藥品配備。
“商保創新藥目錄是一道源頭活水,將為國產創新藥的購買需求帶來一塊很大的增量蛋糕。”華南一家創新藥企業高管向記者表示。
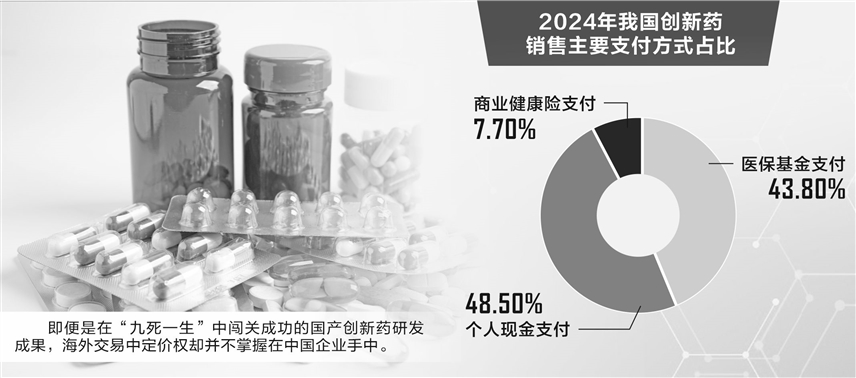
公開數據顯示,2024年我國創新藥銷售市場規模達1620億元,其中醫保基金支付約710億元,占比約43.8%;個人現金支付約786億元,占比約48.5%;商業健康險支付約124億元,占比僅為7.7%。
太平洋人壽原董事長徐敬惠表示,商業保險將成為創新藥械多元支付的重要力量。徐敬惠預測,到2035年,商保支付占比有望達到44%,個人自費負擔將大大降低,同時基本醫保的壓力也將大大緩解。
不僅如此,“16條”還著眼于提升中國創新藥的全球競爭力,提出多項舉措,包括搭建平臺,積極促進國產藥品、醫用耗材進入東盟國家等海外市場;支持鼓勵商業保險擴大對創新藥的投資規模,培育支持創新藥的耐心資本;國家醫保局還準備借鑒國際做法,按照企業自愿原則,執行談判價格保密機制,在價格方面為創新藥“走出去”提供更多支持。